Αναμφίβολα το οξυγόνο μαζί με το νερό αποτελούν τα δύο εξαιρετικής σημασίας συστατικά του σύμπαντος που γέμουν ζωή σε όλο τον κόσμο. Και πώς να μην είναι έτσι αφού χωρίς το πρώτο ο άνθρωπος διατηρείται στη ζωή μόνο μερικά λεπτά ενώ χωρίς νερό λίγες μέρες.

Το νερό ύδωρ κατά την αρχαία ελληνική λαμβάνει ενεργό δράση σε όλες τις πτυχές της ζωής μας από τα κύτταρα, τη φωτοσύνθεση και το περιβάλλον συμπεριλαμβανομένης της θάλασσας. Μάλιστα τα ποσοστά του είναι εντυπωσιακά:
- Καλύπτει το 71% του πλανήτη μας εκ του οποίου το 96,5% βρίσκεται στους ωκεανούς και τις θάλασσες
- Μόνο το 2,5% είναι «γλυκό» (ποτάμια, λίμνες κ.α)
- Το 95% του πόσιμου νερού βρίσκεται στα παγοκαλύμματα (μεγάλες εκτάσεις σκεπασμένες με πάγο)
- Καταλαμβάνει το 70% του ανθρώπινου οργανισμού και το 78% του αίματος και των κυττάρων.
- Αποτελεί έως και το 95% των τροφίμων
Τι είναι όμως αυτό που το κάνει τόσο πολύτιμο; Από τι αποτελείται; Τι ιδιότητες έχει; Σε αυτή τη μικρή αναφορά θα προσπαθήσουμε να απαντήσουμε σε αυτά τα ερωτήματα.
Περιεχόμενα
Το νερό ως «νερό»
Η λέξη «νερό» είναι συνηθέστατα συνυφασμένη με μία από τρεις φάσεις της ύλης την υγρή. Οι δύο άλλες φάσεις είναι η στερεά με το γνωστό μας πάγο (από το αρχαίο ρήμα πήγνυμι), και η αέρια (ως υδρατμός). Και ιδού το θαυμαστό: το νερό είναι η μοναδική ουσία στη γη που απαντάται και στις τρεις φάσεις εντός γήινου εύρους θερμοκρασιών. Έτσι ταυτόχρονα σε ένα ψηλό βουνό το χιόνι (πάγος) λιώνει σε υγρό νερό που εξατμίζεται (αέριο) και δημιουργεί τα σύννεφα.
Οι φάσεις αυτές σχετίζονται με μεταβολές από τη μια στην άλλη. Έτσι το σημείο βρασμού ή ζέσεως για το νερό είναι 100οC (θερμοκρασία μεταβολής από υγρό σε αέριο από όλη τα μάζα του μετά από θέρμανση) και το σημείο τήξεως 0 οC (θερμοκρασία μεταβολής από υγρό σε στερεό). Μέσα σε αυτό το εύρος δε έχει την ικανότητα να μεταβάλλεται από τη μια φάση στην άλλη κατέχοντας αυτά τα σημεία (τιμές) τήξεως και βρασμού εντυπωσιακά μεγαλύτερες από παρόμοιες στη σύσταση χημικές ουσίες (ενώσεις). Για παράδειγμα το παρόμοιο υδρόθειο (Η2S) με θείο (ανήκει στην ίδια ομάδα) αντί οξυγόνο έχει σημείο βρασμού -62 oC που σημαίνει ότι πάνω από αυτή τη θερμοκρασία είναι αέριο και σημείο τήξεως -84 οC κάτω από αυτή είναι στερεό.
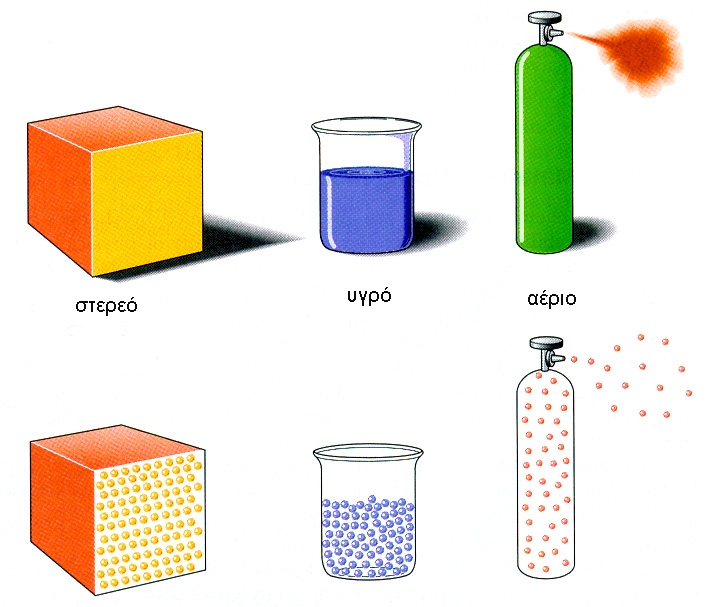
Οι καταστάσεις της ύλης
http://ebooks.edu.gr/ebooks/v/html/8547/2756/Chimeia_A-Lykeiou_html-empl/index1_4.html
To μόριο του νερού
Πριν όμως δούμε τις ιδιότητες του νερού πρέπει πρώτα να κατανοήσουμε τη «φιλοσοφία» του. Όπως πιθανότατα θυμόμαστε από τη σχολική χημεία το νερό έχει μοριακό (χημικό) τύπο Η2Ο (μόριο) δηλαδή αποτελείται από υδρογόνο και οξυγόνο και μάλιστα 2 μέρη (άτομα) από το πρώτο και 1 μέρος (άτομο) από το δεύτερο.
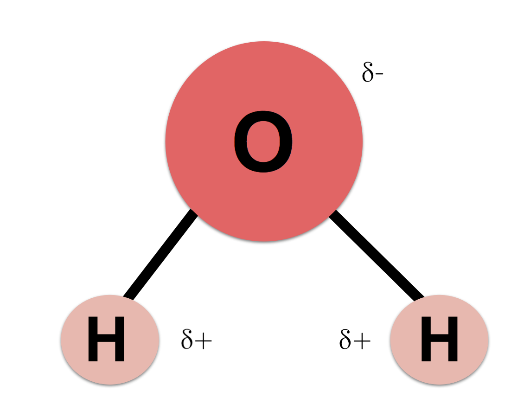
Τι γίνεται τώρα; Οι παύλες μεταξύ των υδρογόνων (Η) και του οξυγόνου (Ο) ονομάζονται δεσμοί. Και από την καθομιλουμένη γνωρίζουμε ότι όσο πιο δυνατοί είναι οι δεσμοί τόσο πιο δύσκολα σπάνε. Και αυτοί είναι δυνατοί γιατί ονομάζονται ομοιοπολικοί. Και πάμε στο «θαύμα». Τα δύο άτομα του υδρογόνου και το άτομο του οξυγόνου δύο ή περισσότερων μορίων νερού αλληλοεπιδρούν μεταξύ τους και σχηματίζουν τους λεγόμενους δεσμούς υδρογόνου (H), που συμβολίζονται τώρα με 3 τελείες:
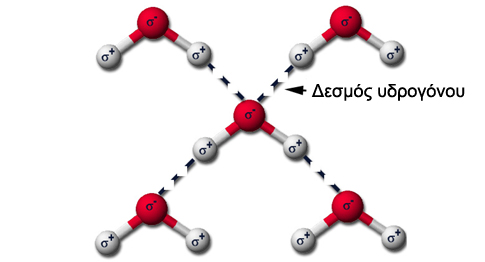
σ+ = υδρογόνο Η
σ– = Οξυγόνο Ο
Μικροσκόπιο διακρίνει για πρώτη φορά το δεσμό υδρογόνου
Έτσι αυτοί φέρνουν κοντά με ηλεκτροστατικές αλληλεπιδράσεις δηλαδή τα ομώνυμα απωθούνται και τα ετερώνυμα έλκονται όπως φαίνεται στο σχήμα με τα σ+ του υδρογόνου και τα σ– του οξυγόνου. Έτσι τα διαφορετικά μόρια του νερού δημιουργούν σε όλη τη μάζα του νέους δυνατούς δεσμούς. Κι εδώ σταματάει η χημεία γιατί όλες οι «μαγικές» ιδιότητες του νερού που θα πούμε στη συνέχεια βασίζονται σε αυτούς τους δεσμούς και στη δυσκολία να λυθούν.
Το νερό: ο παγκόσμιος διαλύτης
Τα διαλύματα είναι φυσική μορφή της ύλης και πιο συγκεκριμένα τα ομογενή μίγματα που τα συστατικά τους δε διακρίνονται ούτε με το κοινό μικροσκόπιο. Σε αντιδιαστολή είναι τα ετερογενή μίγματα όπως ζάχαρη και καφές. Τα διαλύματα λοιπόν αποτελούνται από το διαλύτη που είναι το περισσότερο συστατικό και τις διαλυμένες ουσίες. Να και κάτι άλλο θαυμαστό με το νερό: αναφέρεται ως «παγκόσμιος διαλύτης» δηλαδή διαλύει πάρα μα πάρα πολύ μεγάλο πλήθος χημικών ενώσεων (είδαμε τι είναι)όχι όμως όλες όπως τα λάδια. Αυτό οφείλεται στη λεγόμενη πολικότητα δηλαδή τα σ+ στο υδρογόνο και τα σ– στο οξυγόνο που είδαμε προηγούμενα στην εικόνα. Αυτά περικυκλώνουν με ηλεκτροστατικές δυνάμεις δηλαδή είτε με τα + είτε με – τις τα συστατικά των διαλυμένων ουσιών όπως του αλάτι (NaCl) και τις ενσωματώνουν στο διάλυμα. Αυτό φαίνεται στην παρακάτω εικόνα:
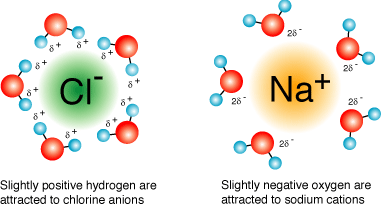
(α)Μερικώς θετικά υδρογόνα περικυκλώνουν τα αρνητικά άτομα χλωρίου (Cl–) και
(β)Μερικώς αρνητικά οξυγόνα περικυκλώνουν τα θετικά άτομα νατρίου (Na+)
Έτσι αποσπούν άτομα αυτά από το κρυσταλλικό πλέγμα του αλατιού (σκεφτείτε του κρυστάλλους του αλατιού) όπως φαίνεται στην παρακάτω εικόνα.
α)κρύσταλλος αλατιού β) αλάτι στο νερό
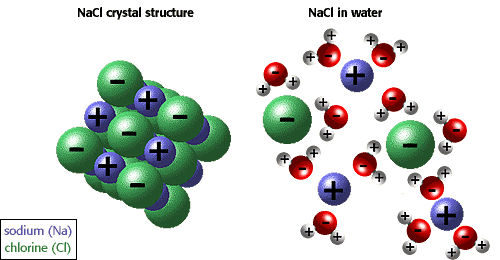
Νάτριο +
Χλώριο –
Να λοιπόν που είδαμε άλλη μια θαυμαστή ιδιότητα του νερού.
Περιεκτικότητες διαλυμάτων
Σε πολλές περιπτώσεις μας ενδιαφέρει η ποσότητα των διαλυμένων ουσιών στο νερό. Έτσι αν δούμε προσεκτικά την διατροφική ετικέτα του εμφιαλωμένων νερών θα παρατηρήσουμε ότι περιέχει πλήθος φορτισμένων ουσιών, που λέγονται ιόντα. Επίσης φαίνονται κάποιες τιμές που δηλώνουν το ζητούμενο που προαναφέραμε.
Αυτές ονομάζονται περιεκτικότητες και αναζητούμε τις εκφράσεις τους:
Περιεκτικότητα στα εκατό κατά βάρος (% w/w)
Η % w/w περιεκτικότητα εκφράζει τη μάζα (σε g) της διαλυμένης ουσίας σε 100 g διαλύματος. Έτσι για παράδειγμα θα πάρουμε ένα σακί λίπασμα 8-6-3. Τι σημαίνουν αυτοί οι αριθμοί; Ένα σακί λίπασμα περιέχει απλά:
8% w/w άζωτο δηλαδή 8 g αζώτου σε 100 g λιπάσματος
6% w/w φώσφορο δηλαδή 6 g φωσφόρου σε 100 g λιπάσματος
3% w/w κάλιο δηλαδή 3 g καλίου σε 100 g διαλύματος
Περιεκτικότητα στα εκατό βάρους κατ’ όγκον (% w/v)
H % w/v περιεκτικότητα εκφράζει τη μάζα (σε g) της διαλυμένης ουσίας σε 100 mL του διαλύματος. Εδώ θα αναφέρουμε την περίπτωση της οξύτητας του ελαιολάδου:
3 γραμμές είναι 0,3%w/v δηλαδή 0,3 οξέα σε 100 ml λαδιού. Επίσης 1 οξέο είναι1%w/v.
Περιεκτικότητα στα εκατό όγκου σε όγκο (% ν/ν)
H % ν/ν περιεκτικότητα εκφράζει τον όγκο (σε mL) της διαλυμένης ουσίας σε 100 mL του διαλύματος.
Το πιο κλασικό παράδειγμα αυτής της περιεκτικότητας είναι η % vol στα οινοπνευματώδη ποτά. To %vol είναι % v/v. Δηλαδή για ένα μπουκάλι κρασί με 12% vol περιέχει 12 ml οινόπνευμα σε 100 ml κρασιού.
Όμοια για ένα μπουκάλι βότκα 40% vol σημαίνει 40 ml οινόπνευμα σε 100 ml βότκα
- Μπορείτε να βρείτε ποια είναι η περιεκτικότητα οινοπνεύματος σε ένα μπουκάλι μπύρα.
- Ποια είναι η περιεκτικότητα % vol της τσικουδιάς
Είναι βέβαια πολύ δύσκολο να τις καταλάβουμε με απλή αναφορά στο άψυχο χαρτί και πρέπει να γίνει ανάλυση στην τάξη. Βέβαια χρειάζεται γνώση απλών μαθηματικών και την απλή μέθοδο των τριών.
Διαλυτότητα
Μία άλλη σπουδαία ιδιότητα των διαλυμάτων είναι η διαλυτότητα. Αυτή είναι:
Διαλυτότητα ορίζεται η μέγιστη ποσότητα μιας ουσίας που μπορεί να διαλυθεί σε ορισμένη ποσότητα διαλύτη, κάτω από ορισμένες συνθήκες(π.χ. θερμοκρασία).
Η διαλυτότητα ορίζεται ως εξής:
x; g διαλυμένης ουσίας σε 100g διαλύτη
Όταν η διαλυμένη ουσία φτάσει και ξεπεράσει αυτή την ποσότητα ονομάζεται κορεσμένο.
Έτσι η διαλυτότητα του αλατιού (χλωριούχο νάτριο, NaCl)) είναι 36 g αλατιού σε 100 g νερού. Δηλαδή αν προσπαθήσουμε να διαλύσουμε αυτή ακριβώς την ποσότητα αλατιού το διάλυμα είναι κορεσμένο δηλαδή όση περισσότερη ουσία κι αν προσθέσουμε θα καθιζάνει. Για παράδειγμα αν ρίξουμε 40 g αλατιού θα διαλυθούν 37 g και θα καθιζάνουν 3 g. Στην αντίθετη περίπτωση δηλαδή αν προσθέσουμε σε 100 g νερού 30 g αλατιού θα διαλυθούν και τα 30 g οπότε το διάλυμα είναι ακόρεστο και μπορούν σύμφωνα με τη διαλυτότητα να διαλυθούν άλλα 7 g.
Σκεφτείτε λοιπόν το αλατόνερο που φτιάχνουμε πολλές φορές. Αν προσθέσουμε αλάτι στο νερό αυτό θα θολώσει αν το ανακατέψουμε όμως γίνεται διαυγές. Όταν βάλουμε περισσότερη ποσότητα αυτό παραμένει θολό και αν το αφήσουμε να ηρεμήσει το περίσσιο αλάτι δημιουργεί ίζημα (κατακάθι).
Το pH
Προηγούμενα είδαμε τον χημικό τύπο του νερού H2O ή Η-Ο-Η. Ε αυτό μπορεί υπό καθορισμένες συνθήκες να διασπαστεί ελάχιστα:
Η2Ο –>Η+ + ΟΗ–
Όταν όμως διαλύσουμε ένα οξύ όπως το γνωστό υδροχλωρικό οξύ ( HCl) σε ένα ποτήρι νερό τότε αυξάνεται η ποσότητα των Η+
HCl –>H++ Cl–
Όταν όμως ρίξουμε μία βάση όπως η καυστική ποτάσα (ΚOH) στο νερό αυξάνονται τα λεγόμενα υδροξείδια (ΟΗ-) και μειώνονται τα Η+
ΚOH–> Κ+ + OH– (Κ=κάλιο)
Η ποσότητα των υδρογόνων (Η+) σε ένα διάλυμα ονομάζεται pH. Το pH παίρνει τιμές από 0-14, που ονομάζονται κλίμακα pH. Έτσι για την τιμή 7 το διάλυμα ονομάζεται ουδέτερο για μικρότερο του 7 όξινο και μεγαλύτερο του 7 αλκαλικό.
Αυτό έχει τεράστια εφαρμογή στη ζωή.
- Στο πεπτικό μας σύστημα το υδροχλωρικό οξύ pH=1 διασπά τις τροφές
- Το pH στο αίμα διατηρείται σταθερά σε συγκεκριμένο εύρος pH=7,2-7,4
- Παίζει πολύ σημαντικό ρόλο στη λειτουργία των πρωτεϊνών
- Ρυθμίζει την οξεοβασική ισορροπία (ομοιόσταση) των κυττάρων
- Συμμετέχει στη δράση των ηλεκτρολυτών με σημαντικότερους αυτούς που ήδη αναφέραμε δηλαδή νάτριο, κάλιο και χλώριο
Οξέα, βάσεις και άλατα
Προηγούμενα όμως αναφέραμε τις λέξεις οξέα, βάσεις και άλατα. Δε θα επεκταθούμε όμως σε αυτά. Θα επαναλάβουμε ότι χημικώς τα οξέα δίνουν στο νερό H+ και οι βάσεις OH– ενώ τα άλατα παράγονται από τα οξέα και τις βάσεις με μια αντίδραση που λέγεται εξουδετέρωση. Παρακάτω δίνονται κλασικά οξέα, βάσεις της καθημερινής μας ζωής:

http://molwave.chem.auth.gr/fabchem/?q=node/77

ebooks.edu.gr
Οι φυσικές ιδιότητες του νερού
Αναφερθήκαμε ήδη στο σημείο ζέσεως του νερού και τώρα μπορούμε να δικαιολογήσουμε την «τρομακτική» σε μέγεθος τιμή τους. Είπαμε για να σπάσουν οι δεσμοί Η απαιτείται μεγάλη δύναμη που τη δίνει η θερμότητα και άλλοι παράγοντες. Όσο περισσότερο ισχυροί είναι τόσο μεγαλύτερη θερμότητα απαιτείται να δώσουμε και κατά συνέπεια πιο υψηλή θερμοκρασία. Όμοια για το σημείο τήξεως όπως αναφέραμε στο παράδειγμα του παρόμοιου υδρόθειου.
Η πυκνότητα του νερού είναι 1kg/L. H πυκνότητα του πάγου είναι 0,92 kg/L. Αυτό έχει ως αποτέλεσμα ο πάγος να επιπλέει στο υγρό νερό όπως τα παγάκια στο φραπέ. Αυτό έχει τεράστια σημασία στη φύση γιατί αν συνέβαινε το αντίθετο τα παγόβουνα θα βυθίζονταν και τα ζώα που ζουν στους πάγους δε θα υπήρχαν. Επίσης οι λίμνες δε θα είχαν φυσική ζωή γιατί το νερό θα ήταν πάγος στον πυθμένα.
Το νερό έχει πολύ υψηλή θερμοχωρητικότητα δηλαδή έχει τη δυνατότητα να αποθηκεύει θερμότητα και να αντιστέκεται στις μεγάλες μεταβολές της θερμοκρασίας. Φανταστείτε την κάψα της άμμου το καλοκαίρι από τον ήλιο και την ανακούφισή με την είσοδο στο νερό. Από την άλλη η θερμοκρασία του νερού βοηθάει τον οργανισμό μας να διατηρεί σταθερή θερμοκρασία
Με τους δεσμούς Η τα μόρια του νερού «κολλάνε» το ένα με το άλλο. Στην επιφάνεια όμως του νερού δεν υπάρχουν μόρια για αυτό το σκοπό οπότε δέχονται δυνάμεις μόνο από το εσωτερικό με αποτέλεσμα να δημιουργείται ένα φιλμ. Αυτό το φαινόμενο λέγεται επιφανειακή τάση. Έτσι για παράδειγμα στο φλιτζάνι του καφέ μόλις το γεμίσουμε μέχρι το χείλος αντιστέκεται στο χύσιμο.
Τα τριχοειδή φαινόμενα είναι ένα άλλο εξαιρετικό παράδειγμα των δυνατοτήτων του νερού. Οι τριχοειδείς (πάρα πολύ μικρής διαμέτρου) σωλήνες έχουν τη δυνατότητα να ανεβάζουν νερό από κάτω προς τα πάνω με το φαινόμενο του προαναφερθέντος «κολλήματος». Αυτή είναι άλλωστε είναι η ιδέα μεταφοράς του νερού από τις ρίζες των φυτών στον κορμό.
Επίλογος
Σε αυτή την εργασία παρουσιάστηκε το νερό ως “νερό” από όλες κατά το δυνατόν διαστάσεις του, όπως η μορφή, οι ιδιότητές και οι εφαρμογές του. Έγινε κατανοητό ότι χάριν σε αυτό το καταπληκτικό δημιούργημα του Θεού υπάρχει ζωή σε αυτό τον κόσμο. Η μεγάλη σημασία του για τον οργανισμό θα δειχτεί σε άλλη ανάρτηση.




Great selection of modern and classic books waiting to be discovered. All free and available in most ereader formats. download free books https://www.philadelphia.edu.jo/library/directors-message-library
Hello. Thank you very much for your kind words. You give us enough energy to keep going.
“Al-Ahliyya Amman University
AAU Started providing academic services in 1990, Al-Ahliyya Amman University (AAU) was the first private university and pioneer of private education in Jordan. AAU has been accorded institutional and programmatic accreditation. It is a member of the International Association of Universities, Federation of the Universities of the Islamic World, Union of Arab Universities and Association of Arab Private Institutions of Higher Education. AAU always seeks distinction by upgrading learning outcomes through the adoption of methods and strategies that depend on a system of quality control and effective follow-up at all its faculties, departments, centers and administrative units. The overall aim is to become a flagship university not only at the Hashemite Kingdom of Jordan level but also at the Arab World level. In this vein, AAU has adopted Information Technology as an essential ingredient in its activities, especially e-learning, and it has incorporated it in its educational processes in all fields of specialization to become the first such university to do so.
https://www.ammanu.edu.jo/“